Οι φθοροχλωράνθρακες (αγγλικά ChloroFluoroCarbons, CFCs), γνωστοί στα ελληνικά και ως χλωροφθοράνθρακες, είναι ομάδα οργανικών χημικών ενώσεων, που κανονικά περιέχουν μόνο άνθρακα, φθόριο και χλώριο, αλλά συχνά συμπεριλαμβάνονται σε αυτές και αυτές που περιέχουν και υδρογόνο, αν και στην περίπτωση αυτή κανονικά οι ενώσεις ονομάζονται «υδροφθοροχλωράνθρακες». Επίσης, συνήθως ως φθοροχλωράνθρακες εννοούνται μόνο τα πτητικά φθοροχλωριούχα παράγωγα του μεθανίου, του αιθανίου και του προπανίου. Τέλος, ορισμένοι συγγραφείς δεν αποκλείουν τη συμμετοχή και του βρωμίου, αν και πάλι, κανονικά, αλλάζει η ονομασία σε (υδρο)βρωμοφθοροχλωράνθρακες. Είναι επίσης κοινώς γνωστά με τη γενική ονομασία «φρεόν». Ο πιο αντιπροσωπευτικός φθοροχλωράνθρακας είναι το διφθοροδιχλωρομεθάνιο (R-12, ή φρεόν-12). Πολλοί φθοροχλωράνθρακες χρησιμοποιήθηκαν ευρύτατα ως ψυκτικά, ως προωθητικά αέρια για καταναλωτικά αερολύματα (αεροζόλ), καθώς και ως διαλύτες. Η παραγωγή τέτοιων ενώσεων έχει τεθεί κάτω από το Πρωτόκολλο του Μόντρεαλ, και η χρήση τους έχει σε μεγάλο ποσοστό αντικατασταθεί με αντίστοιχα προϊόντα που περιέχουν υδροφθοράνθρακες (HydroFluoroCarbons, HFCs), όπως το μίγμα R-410A, κατάλληλους υδρογονάνθρακες και διοξείδιο του άνθρακα, γιατί βρέθηκε ότι οι φθοροχλωράνθρακες συνεισέφεραν στην καταστροφή του στρατοσφαιρικού στρώματος του όζοντος.
Όπως και στα απλούστερα αλκάνια, η μοριακή δομή των ατόμων άνθρακα και των ατόμων που σε συνδέονται σε καθένα από αυτά είναι τετραεδρική και στους φθοροχλωράνθρακες. Εφόσον τα άτομα φθορίου και χλωρίου διαφέρουν πολύ σε μέγεθος και ηλεκτραρνητικότητα και από το υδρογόνο και μεταξυ τους, οι φθοροχλωράνθρακες που είναι παράγωγα του μεθανίου διαφέρουν επίσης από την τέλεια τετραεδρική συμμετρία[1].
Οι φυσικές ιδιότητες των φθοροχλωρανθράκων έχουν αξιοσημείωτες διαφορές ανάλογα με τον αριθμό και την ταυτότητα των ατόμων των αλογόνων που περιέχουν. Σε γενικές γραμμές, είναι οι φθοροχλωράνθρακες είναι πτητικοί, αλλά λιγότερο από τα μητρικά τους αλκάνια. Η μειωμένη πτητικότητα αποδίδεται στη μοριακή πολικότητα, που οφείλεται στην παρουσία των αλογόνων, και προκαλεί διαμοριακές αλληλεπιδράσεις. Έτσι, ενώ το μεθάνιο βράζει στους −161 °C, τα φθορομεθάνια βράζουν μεταξύ -51,7°C (διφθορομεθάνιο) και -128°C (τετραφθοράνθρακας). Οι φθοροχλωράνθρακες έχουν ακόμη μεγαλύτερα σημεία βρασμού, γιατί περιέχουν επιπλέον και χλώριο, που είναι περισσότερο πολώσιμο από το φθόριο. Εξαιτίας ακριβώς της πολικότητάς τους, οι φθοροχλωράνθρακες είναι χρήσιμοι διαλύτες, και, με τα σημεία βρασμού που έχουν, είναι κατάλληλα για ψυκτικά. Οι φθοροχλωράνθρακες είναι πολύ λιγότερο εύφλεκτοι σε σύγκριση με το μεθάνιο, εν μέρει γιατί περιέχουν λιγότερους δεσμούς C-H και εν μέρει γιατί, στην περίπτωση των χλωροπαραγώγων και των βρωμοπαραγώγων, απελευθερώνουν ελεύθερες ρίζες αλογονιδίων, που δεν υποστηρίζουν τις φλόγες.
Οι πυκνότητες των φθοροχλωρανθράκων είναι υψηλότερες εκείνων των αντίστοιχων αλκανίων. Γενικά οι πυκνότητες αυτών των ενώσεων συσχετίζεται με τον αριθμό των ατόμων χλωρίου που περιέχουν ανά μόριο. Επεξηγηματική είναι η σύνθεση του διφθοροχλωρομεθάνιου από χλωροφόρμιο:
Αν είναι επιθυμητή η παρουσία και βρωμίου, τα σχετικά παράγωγα παράγονται με αντιδράσεις ελευθέρων ριζών από φθοροχλωράνθρακες, αντικαθιστώντας δεσμούς C-H με δεσμούς C-Br. Επεξηγηματική είναι η σύνθεση 2-βρωμο-1,1,1-τριφθορο-2-χλωραιθάνιου, που χρησιμεύει ως αναισθητικό:
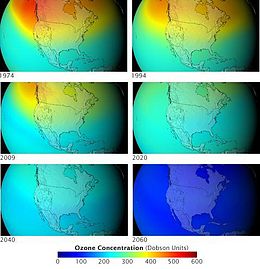
Το ατομικό χλώριο, που γράφεται συχνά ως Cl●, συμπεριφέρεται πολύ διαφορετικά από το μοριακό χλώριο (δηλαδή το «διχλώριο», Cl2). Οι ελεύθερες ρίζες χλωρίου (Cl●) είναι (σχετικά) πολύ μακρόβια στην ανώτερη ατμόσφαιρα, όπου καταλύει τη μετατροπή του όζοντος (O3) σε διοξυγόνο (O2). Το όζον απορροφά μέρος από τη UVB ακτινοβολία, περιορίζοντας την υψηλής ενέργειας ακτινοβολία που φθάνει ως την επιφάνεια της Γης. Οι ελεύθερες ρίζες βρωμίου (Br●) είναι ακόμη πιο αποτελεσματικοί καταλύτες για τη διάσπαση του όζοντος και γι” αυτό τα βρωμιούχα παράγωγα επίσης ελέγχονται από το πρωτόκολλο του Μόντρεαλ.
Οι εφαρμογές των φθοροχλωρανθράκων εκμεταλλεύονται τη χαμηλή τοξικότητα, τη χαμηλή χημική δραστικότητα και τη χαμηλή ευφλεκτότητα των ενώσεων αυτών. Κάθε συνδυασμός φθορίου, χλωρίου και υδρογόνου σε παράγωγα του μεθανίου και του αιθανίου έχουν εξετασθεί και οι περισσότεροι έχουν ήδη εμπορικές εφαρμογές. Επιπλέον, υπάρχουν πολλά αντίστοιχα παραδείγματα για ενώσεις με περισσότερα άτομα άνθρακα ή που περιέχουν και βρώμιο. Οι εφαρμογές περιλαμβάνουν ψυκτικά, παράγοντες διογκώσεως, προωθητικά αέρια, ιδιαίτερα σε ιατρικές εφαρμογές, και απογρασωτικούς διαλύτες.
Εκατομμύρια τόννοι διφθοροχλωρομεθάνιου παράγονται ετησίως, ως πρόδρομη ένωση για το τετραιθένιο, το μονομερές που μετατρέπεται σε τεφλόν

